LOS AGENTES
QUELANTES Y LA SECUESTRACION (Secuestrantes)
La Quelatación se define como
la formación de complejos solubles de iones metálicos en presencia de agentes químicos
que normalmente producirían precipitados en soluciones acuosas. El mismo término se
utiliza para describir la solubilización en agua de precipitados de iones metálicos. Los
dos procesos son idénticos en el sentido de que el mismo equilibrio se alcanza para el
mismo conjunto dado de componentes. Los compuestos capaces de ligar iones metálicos de
tal manera que ellos no exhiban sus reacciones normales en presencia de agentes
precipitantes se conocen como agentes secuestradores o secuestrantes. El término
secuestración se ha extendido en los últimos años para incluir aquellos sistemas en los
cuales el agente secuestrante se usa para enmascarar la actividad química o biológica de
un ion metálico en reacciones diferentes a los procesos de precipitación. Es importante
enfatizar que la reacción de secuestración es frecuentemente parte de un proceso global
en el cual se ha encontrado deseable incrementar o inhibir una reacción influenciada por
un ion metálico, la cual tiene lugar independientemente de la reacción de coordinación,
o para alterar la influencia de un ion metálico sobre la estabilidad de un producto o
componente. Por ejemplo la presencia de un agente secuestrante en una solución de un
jabón de sodio en agua dura liga los iones Calcio y Magnesio de tal manera que la acción
del detergente procede mas eficientemente. La adición de un agente secuestrante a una
solución de acido ascórbico estabiliza la vitamina contra la oxidación combinándose
con las impurezas de los iones metálicos presentes, las cuales catalizan la degradación
oxidativa.
La secuestración pertenece al campo
de la química de coordinación. Para entender los mecanismos involucrados en la ligazón
de un ion metálico por un agente secuestrante (formación de quelatos metálicos), es
necesario considerar los fundamentos de la formación de complejos metálicos en
solución. La evaluación de este proceso esta asociada con el equilibrio iónico de
soluciones acuosas tanto de electrolitos fuertes como débiles.
Los agentes secuestrantes disponibles
comercialmente se clasifican en general como orgánicos o inorgánicos. Los
polifosfatos condensados son los agentes secuestrantes inorgánicos mas ampliamente
usados. De los agentes secuestrantes orgánicos, dos grupos son de importancia económica.
Ellos son los ácidos Amino-Policarboxílicos tales como el acido
Etilendiaminotetraacético (EDTA), y los ácidos hidroxi-carboxílicos tales como el
ácido Glucónico, el ácido Cítrico y el ácido Tartárico. La Lignina y sus derivados,
el acido Lignosulfónico, debido a sus grupos hidroxi-fenólicos ha sido sugerido en
solución como agente secuestrante para Calcio y el Magnesio en sistemas que contienen
jabón. También se ha introducido una nueva clase de agentes secuestrantes solubles en
aceite u oleosolubles.
ESTABILIDAD DE LOS
QUELATOS
La fuerza de la ligazón entre los
iones metálicos y los ligandos ha sido objeto de extensas investigaciones. Las
propiedades de los metales tales como número atómico, potencial de ionización, radio
iónico, y orbitales-d, han sido usadas para explicar la formación de los quelatos
metálicos. También se ha establecido experimentalmente que el orden de estabilidad de
los quelatos de los diversos metales es aproximadamente igual para un gran número de
agentes acomplejantes y quelatantes.
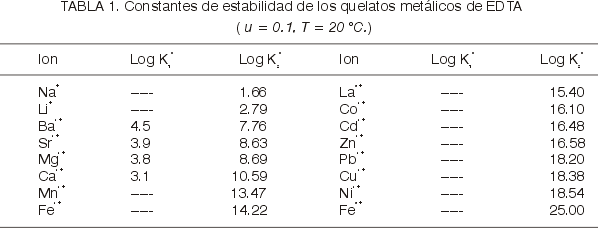
Para la serie de los metales
alcalinotérreos el orden de estabilidad de los quelatos de EDTA es:
Ba<Sr<Mg<Ca
El Magnesio ocupa una posición algo
variable, ya que, con algunos agentes quelantes, forma complejos mas estables que el
calcio, aunque para los acidos aminopolicarboxílicos, los quelatos de Calcio son
usualmente mas estables.
La estabilidad de algunos de los
quelatos de los iones de los metales bivalentes de transición sigue el siguiente
orden:
Mn< Fe< Cd< Zn< Co<
Ni< Cu
El orden de estabilidad tiene una
importante consecuencia en el uso de los agentes secuestrantes en sistemas donde dos o mas
iones metálicos pueden estar presentes. El equilibrio que gobierna la actividad de dos o
mas iones metálicos frente al ligando es complejo. Factores tales como las constantes de
estabilidad de los quelatos metálicos, las concentraciones de los iones metálicos y de
los ligandos, la naturaleza y la concentrración de los electrolitos no competitivos
presentes en la solución, el pH, la solubilidad de los hidróxidos metálicos, y otras
variables afectan la distribución de la fracción quelatada y no quelatada de los iones
metálicos. Para muchas aplicaciones, los ácidos amino-policarboxílicos deben ser
clasificados como reactivos no específicos. Sin embargo es posible mediante un adecuado
control de las condiciones experimentales, confinar la acción de un agente secuestrante a
un número limitado de iones metálicos, y en algunos casos a un ion simple.
Dos iones metálicos pueden ser
separados mediante el uso de agentes secuestrantes si el pH se ajusta al punto donde un
hidróxido metálico se precipita de la solución. Por ejemplo en soluciones ácidas de
Titanio (IV) y Hierro (III) que contienen EDTA, la adición de Amoníaco hasta pH 4
precipitará el Hidróxido de Titanio, dejando el Hierro en solución como complejo
EDTA.
Pfeiffer y Schmitz demostraron que
las estabilidades de los quelatos metálicos de EDTA se afectan marcadamente por la
presencia de otros iones metálicos bivalentes. Asípor ejemplo, la sal disódica del
quelato de Cobre-EDTA es estable en solución alcalina, pero la adición de iones calcio o
zinc producirán un precipitado de hidróxido de cobre. La adición de fosfato amónico u
oxalato de sodio a una solución de Zinc-Calcio-EDTA precipitará fosfato amónico de zinc
u oxalato de calcio. La disminución de la estabilidad de los quelatos metálicos en
presencia de sales bivalentes puede ser atribuida al efecto de estos electrolitos sobre la
fuerza iónica de la solución o por la formación de complejos bimetálicos de
EDTA.
ACIDOS AMINO
POLICARBOXILICOS
La tendencia de los aminoácidos
naturales a combinarse con los iones metálicos ha sido activamente estudiada por muchos
años pero ninguno de estos compuestos forma quelatos estables con el Magnesio o con los
metales alcalino-terreos. El descubrimiento de que el ácido NitriloTriAcético (NTA) y el
Etilendinitrilotetraacético (EDTA), ambos con un estructura alfa-amino, podían
combinarse con el Calcio y el Magnesio para formar complejos altamente estables en el
rango de pH de 7 a 12 enfocó la atención de muchos investigadores a esta clase de
compuestos. Las primeras aplicaciones de estos agentes secuestrantes para sobrepasar los
efectos deletéreos de los iones metálicos del agua dura sobre los textiles y los
procesos de lavandería llevaron a un reconocimiento limitado de su utilidad comercial.
Las investigaciones de Pfeiffer, Brintzinger y otros sobre las reacciones del acido
NitriloTriacético y el EDTA con los metales contribuyeron grandemente a la clarificación
de la composición química y de las propiedades de los quelatos metálicos aislados. El
trabajo de Schwarzenbach y colaboradores, dilucidó los aspectos físicos y químicos de
las interacciones de los iones metálicos en solución acuosa con los ácidos
Amino-policarboxílicos. Schwarzenbach acuño el término de "Complexones" para
esta clase de compuestos. Estos investigadores tuvieron éxito al correlacionar muchas
relaciones importantes entre la estructura de estos compuestos y la estabilidad de sus
complejos metálicos. Los conceptos básicos desarrollados de este trabajo condujeron al
uso extensivo del EDTA en química analítica y suplieron una mas precisa interpretación
química y dirección para las aplicaciones prácticas de los agentes
secuestrantes.
De los varios ácidos
Amino-Policarboxílicos que se han utilizado como agentes secuestrantes, el EDTA es el que
tiene las mas amplias aplicaciones.
ACIDOS
HIDROXI-CARBOXILICOS
El ácido Glucónico,
el ácido Cítrico y el ácido Tartárico son de considerable interés como agentes
secuestrantes. Un compuesto relacionado, el ácido sacárico, también ha sido usado en
pequeña escala como agente secuestrante en solución alcalina. El mecanismo mediante el
cual los ácidos Hidroxi-Carboxílicos previenen la formación de sales insolubles de los
iones metálicos no ha sido completamente clarificado; esto es especialmente válido para
los gluconatos metálicos en soluciones alcalinas.
Las constantes de estabilidad
de los complejos de Calcio y Magnesio de los ácidos glucónico y Cítrico
han sido determinadas. Ellas son de un orden mucho menor que las del EDTA.
En la figura 1. se muestra la actividad secuestrante para el Calcio de
estos compuestos, determinada por el método de turbidez del Oxalato. Todos
estos hidroxi-ácidos muestran un incremento en la secuestración del Calcio
con el incremento de la alcalinidad. 
En la
figura 2. se ilustra gráficamente la habilidad del ácido Cítrico
y del ácido Glucónico para prevenir la precipitación del Hidróxido Férrico
(III). El Gluconato de Sodio exhibe la mas fuerte actividad secuestrante
para Hierro (III) a concentraciones de Hidróxido de Sodio del 2-4%. Compárese
con la figura No. 1, en la cual el EDTA ofrece un mayor poder secuestrante
para el Calcio que el ácido Glucónico. Por esto el ácido Glucónico en
medios alcalinos y en presencia de Calcio es un Secuestrante altamente
específico para metales como el Hierro y el Manganeso.

Resultados similares han sido
obtenidos con otros ácidos Hidroxi-Carboxílicos. Parece que la prevención de la
precipitación por los ácidos Hidroxi-Carboxílicos puede ser debida al efecto
"Threshold" también llamado efecto "Umbral", mas que a la verdadera
secuestración. En el efecto "Threshold", la reacción entre un ion metálico y
un agente precipitante no alcanza el equilibrio debido al efecto inhibitorio del ácido
Hidroxi-Carboxílico. En muchas aplicaciones, la formación retardada de un precipitado
insoluble es tan efectiva como la verdadera quelatación. Es posible distinguir entre el
efecto "Threshold" y la verdadera secuestración por aproximación al equilibrio
desde direcciones opuestas. Así, si la cantidad de iones Calcio que pueden mantenerse en
solución por un agente secuestrante en presencia de iones oxalato es la misma que
la cantidad de Oxalato de Calcio que puede ser solubilizada por el mismo agente bajo las
mismas condiciones, el proceso es verdadera secuestración. En el efecto
"Threshold", la cantidad de Calcio que puede ser mantenida en solución excede
la cantidad de Oxalato de Calcio que puede ser solubilizada por el agente
secuestrante.
USOS DE LOS AGENTES
QUELANTES
Entre los principales usos de los
agentes quelantes tenemos los siguientes:
Ablandamiento de agua y
Detergencia
Fabricación de Jabones y
Shampoos
Lavado de Botellas en soluciones
alcalinas
Usos Analíticos
Separación de Metales
Tratamiento y Limpieza de
Metales
Electroplateado y grabado del
Aluminio
Descontaminación de Superficies
Radioactivas
Usos Agrícolas
Usos en Industria
Alimenticia
Usos Fisiológicos y
Farmacéuticos
Industria del Caucho y de los
Polímeros
Industria Textil.
USOS AGRICOLAS
La corrección exitosa de
deficiencias de Hierro en huertos de Cítricos en la Florida Central por tratamiento con
la sal Trisódica del EDTA o por el quelato de Hierro-EDTA fue reportada por Stewart y
Leonard (Citrus Magazine No. 10, 1952). Los suelos que mejor respondieron a este
tratamiento fueron los suelos ácidos. Los huertos de Cítricos deficientes en Hierro
crecidos en suelos alcalino-calcáreos de la costa este de la Florida y en los suelos
alcalinos de California no respondieron favorablemente al tratamiento con Hierro-EDTA.
Esto fue atribuido a la remoción del Hierro del quelato por los constituyentes alcalinos
del suelo. Resultados preliminares indican que los Quelatos de Hierro de los ácidos
(Hidroxietil) Etilendiaminotriacético (HEDTA) y DietilenTriaminoPentaAcético (DTPA)
pueden ser efectivos en suelos alcalinos. Sin embargo la deficiencia de Hierro se corrige
mejor con el Quelato de Hierro del ácido Glucónico, el cual es altamente específico
para este elemento. Entre las diversas plantas que han sido exitosamente tratadas para
deficiencias de Hierro con quelatos de Hierro están el Maíz, la Arveja, la Lechuga, los
Aguacates, las Azaleas y las Cosechas de Forraje.
Hoy en día se utilizan ampliamente
los quelatos de Zinc, Cobre y Manganeso para tratar deficiencias de micronutrientes en
diversas clases de plantas.
Las fumigaciones de agroquímicos que
se ven afectadas por el agua dura han sido aplicadas con buenos reesultados a partir de
dispersiones o soluciones que contienen sales solubles de EDTA. La presencia del 2 - 5 %
de una sal soluble de EDTA en la formulación al 40 % del acido 2,4-Diclorofenoxiacético
(2,4-D) previene la formación de la sal insoluble de Calcio del 2,4-D en agua dura. El
Acido Cítrico neutralizado con aminas tales como la Trietanolamina es ampliamente usado
en esta aplicación y ha desplazado en parte el uso del EDTA.
|

